EDITO
En 2025 : l’optimisation du processus d’accréditation continue !
L’année 2024, riche d’événements pour le Cofrac, s’est terminée par l’évaluation de ses pairs européens en vue de son maintien dans l’accord de reconnaissance mutuel d’EA (European Accreditation). Les conclusions en sont particulièrement positives ! Pour bien commencer cette nouvelle année, vous trouverez également dans ce numéro des précisions sur les dernières évolutions clefs du processus d’accréditation, le retour d’expérience de la phase pilote du projet OMEGA ainsi qu’une première nouveauté avec la publication de la procédure GEN PROC 29 qui porte sur les modalités particulières de la référence à l’accréditation… et toujours les rubriques « recrutement » et « Focus spécial Evaluateur ». |
|
|
|
|---|
|
Conclusions de l’évaluation de la section Santé Humaine par ses pairs européens
Comme tous les quatre ans, le Cofrac a été évalué du 25 au 29 novembre 2024 par ses pairs européens en vue de son maintien dans l’accord de reconnaissance d’EA (European Accreditation) pour l’ensemble des référentiels pour lesquels il est signataire.
Pour la section Santé Humaine, les membres de l’équipe d’EA ont pu évaluer la totalité du processus d’accréditation via l’examen des dispositions, des exercices de traçabilité, des interviews du personnel de la structure permanente, l’interview d’un membre du Comité de section et l’observation d’une évaluation au sein d’un laboratoire de biologie médicale. Ils ont souligné à cette occasion le bon niveau de préparation et la pertinence des évaluations ainsi que la forte implication des parties intéressées.
Les conclusions de cette évaluation sont très positives et ont mis en exergue le respect des exigences internationales en matière d’accréditation, la performance du système en place et la compétence des différents intervenants du processus d’accréditation (équipes du Cofrac, évaluateurs, …). Quelques pistes d’amélioration ont été identifiées qui devraient nous aider à poursuivre l’optimisation de nos process. |
|
|
|
|---|
| | |
OPTIMISATION DU PROCESSUS D'ACCREDITATION |
|
|---|
|
Publication de la GEN PROC 29 concernant les modalités particulières pour la référence à l’accréditation
Face aux obstacles techniques évoqués par certains LBM pour respecter l’exigence européenne d’apposition systématique de la marque d’accréditation (ou de la référence textuelle à l’accréditation), le Cofrac avait sollicité EA (European Accreditation) sur l’acceptabilité de moyens permettant une identification non ambigüe des résultats produits sous accréditation, différents de l’identification individuelle sur les comptes-rendus des examens accrédités.
EA a considéré que, dans ce contexte uniquement, le recours à une solution alternative visant à faire référence à une liste des activités accréditées permettait d’atteindre les objectifs du document EA 3/01 de manière acceptable, sous certaines conditions et pour un usage clairement défini.
Le Cofrac a donc décidé d’ouvrir la possibilité de mise en œuvre de cette solution alternative pour les LBM situés sur le territoire français qui rencontrent des obstacles techniques et qui en font la demande.
La procédure GEN PROC 29, applicable au 1er juillet 2025, définit les modalités particulières pour la référence à l’accréditation en termes de mise en œuvre de la solution alternative définies par EA et d’évaluation qui seront appliquées.
Les LBM, qui souhaitent appliquer cette solution alternative, sont invités à déclarer, auprès du pilote de leur dossier et avant le 1er mai 2025, leur intention de recourir à ces modalités particulières pour la référence à l’accréditation. Le respect de l’exigence d’apposition systématique de la marque d’accréditation (ou de la référence textuelle à l’accréditation) sera évalué pour tous les LBM au cours des évaluations périodiques, à compter du 1er janvier 2026. |
|
|
|
|---|
|
Phases Pré et Post-analytiques en biologie médicale : enregistrement de la nouvelle ligne de portée BM PP01 sur l’application Flexi+ Suite à la révision du document SH REF 08 (cf. lien actualité), la réalisation des phases pré- et post-analytiques de l’ensemble de l’activité de biologie médicale du LBM est couverte par deux nouvelles lignes de portée BM PP01 & BM PP02. Seule la ligne BM PP01 décrivant les prélèvements effectués par le personnel du LBM soit en son sein soit à l’extérieur doit être complétée par une portée détaillée. Pour rappel, celle-ci était à enregistrer dans la partie « demande d’extension » de l’application Flexi+ au plus tard pour le 31/12/2024. Pour vous faciliter l’intégration de la portée détaillée correspondant à une demande d’extension, une amélioration a été apportée à l’application Flexi+ permettant l’intégration massive des lignes de portée détaillée. Vous trouverez ci-dessous les liens vers les fiches mémo : |
|
|
|
|---|
|
Focus sur deux évolutions principales de la dernière révision du document SH REF 08 « Expression et évaluation des portées d’accréditation »
La révision 7 du document SH REF 08 « Expression et évaluation des portées d’accréditation » est applicable depuis le 1e octobre dernier. - Périmètre d’accréditation si plusieurs équipements sont utilisés pour un même examen/analyse (§8.2.2)
Les examens/analyses (hors examens de biologie médicale délocalisés) figurant dans la portée détaillée, pour un même site de la structure et pour une même technique individuelle, sont couverts par l’accréditation quels que soient les équipements utilisés (automate principal / automate de back-up, automates en miroir par exemple). Par exemple, si une structure réalise sur un même site les phénotypages ABO (ligne de portée BM IH01) par le biais de 2 automates, ces 2 automates sont couverts par l’accréditation et doivent apparaître dans la portée détaillée. Si la structure ne souhaite pas présenter à l’accréditation pour un examen/analyse donné, l’ensemble des sites de réalisation et des techniques individuelles, elle devra s’assurer de distinguer le site de réalisation et/ou la technique individuelle pratiquée tout au long du processus de réalisation de l’examen/analyse (depuis l’information aux utilisateurs jusqu’au rendu des résultats), le compte-rendu d’examens différenciant sans ambiguïté les résultats des examens en fonction du site de réalisation et/ou de la technique individuelle pratiquée.
Par exemple, si une structure réalise sur 2 sites différents les phénotypages ABO (ligne de portée BM IH01) par le biais du même automate, elle peut (sous réserve des conditions évoquées ci-dessus) ne présenter qu’un seul site. Seul l’automate correspondant au site choisi est couvert par l’accréditation et doit apparaitre dans la portée détaillée. Les mêmes principes s’appliquent aux examens de biologie médicale délocalisés – EBMD (cf. §8.2.3). 2. Comparabilité des résultats (§8.2.2) Pour un examen donné, si la structure prend en compte des résultats obtenus par d’autres techniques individuelles et/ou par d’autres sites, y compris pour des EBMD, elle doit s’assurer de la comparabilité des résultats, que ces sites et techniques individuelles figurent ou non dans la portée d’accréditation. Par exemple, une structure réalise la NFS sur le site A et le site B (ligne de portée BM HB01), mais seul le site A est présent dans la portée d’accréditation. Si la structure prend en compte les résultats obtenus sur les 2 sites, elle doit s’assurer de la comparabilité de ces résultats, via une stratégie définie, argumentée et documentée (cf. document SH REF 02 §7.3.7.4). |
|
|
|
|---|
|
| | Rex sur la phase pilote Omega | | |
| En octobre 2022, le Cofrac diffusait les résultats de la consultation lancée auprès de l’ensemble des organismes accrédités et membres d’instance sur des nouveaux principes pour renforcer l’individualisation des évaluations des organismes accrédités dans le cadre du projet OMEGA (Optimisation des Modalités d’Evaluation et de Gestion des Accréditation) alors envisagés, résultats qui témoignaient d’un fort intérêt pour la démarche. | | |
|
|
|
|---|
|
Depuis lors, une première phase d’expérimentation de ces nouveaux principes, dite phase pilote, a été engagée et ses résultats sont disponibles sur notre site. En santé humaine, 16 laboratoires (laboratoires hospitaliers, autres publics, privés) ont participé à cette phase pilote, qui s’est focalisée sur l’expérimentation des nouvelles modalités de suivi des écarts. Appréciée par les laboratoires participants et les évaluateurs, cette approche permet d’optimiser à la fois la vérification du traitement des écarts et l’usage du temps d’évaluation sur site pour le mettre à profit sur les sujets les plus à risques. |
|
|
|
|---|
|
L’expression de la portée détaillée correspondant aux processus complexes peut être simplifiée (SH INF 50 révision 8, paragraphe 6.2) | | |
|
|
|
|---|
|
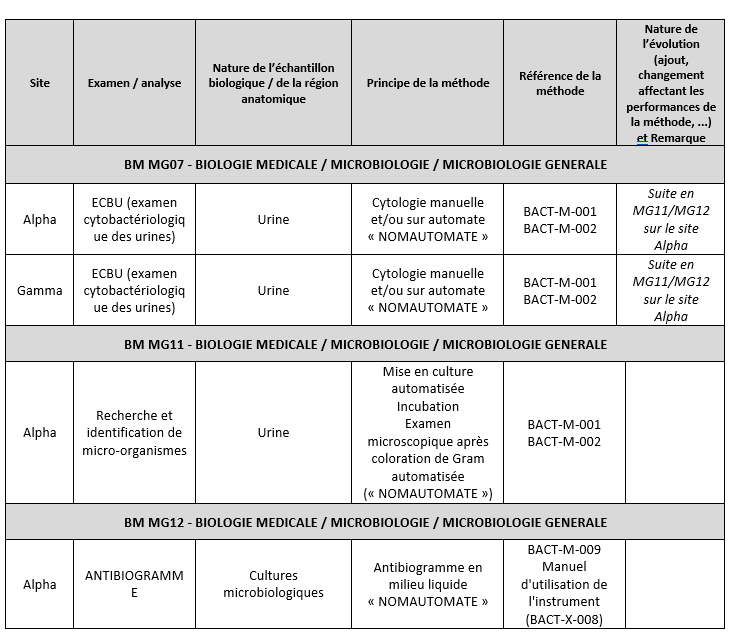
Pour les examens relevant de processus complexes impliquant plusieurs sous-processus faisant appel à des lignes de portée (LP) différentes, l’examen doit être mentionné pour chaque LP concernée. Exemple pour l’électrophorèse des protéines sériques en biochimie générale et spécialisée : il convient de préciser « électrophorèse des protéines sériques » dans la LP BB01 (pour le dosage des protides) et dans la LP BB04 (pour la séparation des fractions). Il est possible de procéder à un regroupement des sous-processus communs à différents examens relevant de processus complexes, sous réserve d’indiquer pour la LP correspondant au premier sous-processus les LP concernées par la suite du processus. Exemple pour l’ECB en microbiologie générale, qui fait appel aux LP MG07 / si besoin MG10 / MG11 / MG12 : il est possible de mutualiser les sous-processus correspondant aux LP MG10, MG11 et MG12, sous réserve d’indiquer dans la colonne « remarque », pour l’examen ECB au sein du premier sous-processus (ici, la LP MG07), que le processus se poursuit avec les autres LP. Pour celles-ci, il ne sera pas nécessaire de répéter en détails les examens (comme l’ECB par exemple) concernés par ces sous-processus (cf exemple ci-dessous). |
|  |
|
|
|---|
| | |
Une démarche d’accréditation facilitée pour l’introduction d’examens comme D-Dimères, Troponine, BNP, HCG et CRP sur des sites sans activité analytique ! Ces sites n’étant accrédités que pour les phases pré et postanalytiques des examens de biologie médicale, l’introduction d’examens « de première intention » comme D-Dimères, Troponine, BNP, HCG et CRP dans la portée d’accréditation ne peut relever, au regard des exigences européennes d’accréditation, de la flexibilité de la portée d’accréditation mais doit faire l’objet d’une demande d’extension. Dans cet exemple, les examens Troponine, BNP, HCG et CRP relèvent de la ligne de portée (LP) BB01. L’examen D-Dimères relève en principe de la LP CB02. Cela étant les dispositions du paragraphe 6.1.3 b) du document SH INF 50 en vigueur permettent d’affecter, dans la mesure où cet examen est réalisé dans un cadre de première intention, les D-Dimères à la LP BB01 – sous réserve que la LP CB02 soit présente sur au moins un des sites du LBM. Dans cet exemple, la demande d’extension, le cas échéant, peut donc porter uniquement sur la LP BB01. Les compétences mises en œuvre par cette LP étant très « communes », elle peut bénéficier des mesures d’optimisation prévues par le règlement d’accréditation SH REF 05 en vigueur : - Modalités d’accréditation en cas d’extension
La LP BB01 fait aujourd’hui déjà partie du périmètre d’accréditation des LBM. Sa demande sur d’autres sites du périmètre d’accréditation peut bénéficier de modalités d’évaluation par voie documentaire (cf. document SH REF 05 §10.2.2.2). Le délai de traitement d’une telle demande, entre la réception du dossier complet et la proposition de l’équipe pour une évaluation par voie documentaire (réduite en principe à un évaluateur technique), est aujourd’hui estimé en moyenne à 3 mois. - Modalités de surveillance
Sous réserve de la prise en compte des risques identifiés, de la connaissance du LBM et de sa performance (cf. document SH REF 05 annexe 2 § B), chaque site concerné pourrait n’être visité qu’une seule fois sur un cycle d’accréditation (5 ans) par un seul évaluateur technique avec une durée d’intervention optimisée au regard notamment de l’activité réalisée. |
|
|
|
|---|
|
Des comportements adaptés = Une évaluation réussie | | |
| Pour une évaluation orientée vers le Service Médical Rendu, une charte de bon déroulement d'une évaluation est mise à disposition des évalués et des évaluateurs du Cofrac. Cette charte décrit les responsabilités mutuelles des évaluateurs et des évalués et promeut des échanges constructifs permettant le bon déroulement d’une évaluation selon des bonnes pratiques collectives à adopter. Comme indiqué dans celle-ci, l’évaluation a pour but de vérifier l’adéquation des pratiques au regard notamment des exigences d’accréditation. Ces exigences couvrent des thématiques diverses telles que définies dans la norme NF EN ISO 15189 et explicitées dans le document SH REF 02. Comme précisé dans le document SH REF 02 §6.1, la vérification du respect des exigences en matière de sécurité des personnes, telles qu’elles apparaissent dans la norme, est couvert en France par la législation et ne relève pas de la mission des évaluateurs du Cofrac. Cela étant, l’équipe d’évaluation doit uniquement s’assurer que le laboratoire possède des dispositions lui permettant de se tenir informé de la réglementation en vigueur. | | |
|
|
|
|---|
|
| | En outre, en cas de constat au cours de l’évaluation d’une situation non conforme au regard de la réglementation portant sur des aspects d’hygiène et de sécurité, les évaluateurs sont invités à consigner la situation rencontrée dans le rapport d’évaluation. | | |
|
|
|
|---|
|
Lors d’une évaluation au laboratoire ou dans les services de soins (dans le cadre de l’évaluation des EBMD), l’importance de la vigilance de tout un chacun sur la sécurité des personnes est nécessaire. Les moyens mis en œuvre pour mener les investigations lors d’une évaluation ne doivent pas être choisis au détriment de la sécurité des évaluateurs comme du personnel du laboratoire (ou du personnel médical dans le cadre des EBMD). |
|
|
|---|
|
REVISON DOCUMENTAIRE/NOUVELLES PUBLICATIONS |
|
|---|
|
Rubrique « Espace Documentaire » puis « Documentation générale » > 2. Procédures (PROC) : GEN PROC 20 révision 05 - Situations à signaler au Cofrac et transfert d'accréditation applicable au 01/01/2025. Cette version de la procédure vise à faciliter la compréhension de certaines dispositions avec l’ajout d’exemples sur les situations devant être signalées au Cofrac par les organismes (§ 6.1), de précisions concernant certains types de changements qui sont à signaler au plus tôt au Cofrac, compte tenu de l’impact sur la validité de l’accréditation. Des clarifications ont également été apportées sur les conséquences de certaines opérations juridiques des organismes sur leur accréditation (§ 7.5 et 7.6) : en particulier le caractère non cessible de l’accréditation qui reste propre à chaque organisme et l’impossibilité de reprendre une accréditation devenue caduque. Enfin, le § 8.1 relatifs aux prérequis à un transfert d’accréditation a été précisé. |
|
|
|
|---|
| | |
| | Nous cherchons toujours à renforcer notre communauté d’évaluateurs/experts techniques en Immunologie Cellulaire et Histocompatibilité (notamment en immunologie cellulaire), en génétique constitutionnelle et génétique somatique (notamment en cytogénétique) et en Anatomie et Cytologie Pathologiques. | | |
|
|
|
|---|
|
FOCUS SPECIAL EVALUATEURS |
|
|---|
|
| | | | | |  | | | | | |
|
|---|
|
La section Santé Humaine lance son nouveau cycle d’harmonisation pour l’année 2025. La ligne directrice de cette campagne d’harmonisation sera « l’Evolution » : - Evolution dans les sujets développés pour l’approche d’évaluation, - Evolution dans le format des réunions. Une harmonisation générale est prévue. Les sessions regrouperont soit les ETRE, soit les EQRE associés aux ET non qualifiés RE. Cette harmonisation s’appuiera sur un module préparatoire complété par une journée sur site avec une trentaine d’évaluateurs par session afin de faciliter les échanges sur les thématiques développées, réaliser des exercices en groupe et répondre aux questions. Les sessions mixtes « EQRE, EQJ, ET non qualifiés RE - NF EN ISO 15189 » sont prévues les 13, 16, 26 Mai & 5, 17, 19, 23, 25, 30 Juin & 4, 15 Septembre. Les sessions réservées aux « ETRE - NF EN ISO 15189 » sont prévues les 11 juin, 3 juillet et 17 Septembre. En cas d’indisponibilité sur ces créneaux, un rattrapage sera proposé sur la semaine 41.
Une harmonisation technique « ACP » est, quant à elle, envisagée sur la fin du second semestre 2025.
N’hésitez pas à revenir vers Caroline PECQUEUR si vous identifiez des sujets pour lesquels l’harmonisation des équipes d’évaluation serait à renforcer. |
|
|---|
| | |
Cette newsletter est la vôtre ! N’hésitez pas à nous contacter pour nous faire part de vos commentaires, vos retours d'expérience et de vos souhaits quant aux sujets à aborder. |
| |
|---|
|
| |  | |
| |
|---|
|
|
|
|
|
|
|---|
|
Cet email a été envoyé à {{ contact.EMAIL }}. |
| | |
|
|
|---|
|
|
|